Code IUD et UDI : identification unique des dispositifs médicaux et leur traçabilité.
17 juin 2021

Nous vous proposons dans cet article de vous présenter le code IUD, code unique des dispositifs médicaux. Nous positionnerons ici ce code dans l’environnement de la traçabilité réglementaire des dispositifs médicaux. Nous mettrons en avant le bien-fondé de ce code sans pour autant oublier le travail important que les PUI (Pharmacie hospitalières) ont effectué depuis des années sur la traçabilité des dispositifs médicaux implantables. Comment devons-nous mettre en place ce code dans nos PUI hospitalières ? Nous placerons ce code dans l’arsenal législatif que nous proposent les tutelles. Vous découvrirez aussi comment sont structurés les codes-barres ce qui vous permettra de décoder un code-barres sans douchette. Nous vous souhaitons une bonne lecture.
IUD, UDI et traçabilité des dispositifs médicaux – un peu d’histoire ?
La traçabilité sanitaire des dispositifs médicaux est particulièrement importante car elle permet de relier chaque dispositif médical à l’identité du patient qui en a bénéficié. Ainsi, en cas de problème sur un dispositif médical il devient possible de retrouver les patients.
Depuis 2006, il est obligatoire de tracer les dispositifs médicaux implantables (DMI). Le circuit des DMI, au sein de tous les établissements de santé, doit respecter ces obligations depuis cette date. En effet, c’est le décret n° 2006-1497 du 29 novembre 2006 fixant les règles particulières de la matériovigilance et de la traçabilité de certains DM depuis leur réception jusqu’à leur utilisation chez le patient qui porte cette réglementation.
Les dispositifs médicaux ne disposant pas de code unique pour les identifier, il était très compliqué pour les centres de soins de tracer informatiquement ces produits. Les centres se sont donc organisés pour suivre ce décret et sécuriser le circuit des dispositifs médicaux. Une traçabilité papier est donc généralement organisée. Certains centres ont mis en place une traçabilité par réétiquetage.
Le système de réétiquetage permet au centre, lors de la réception d’un dispositif médical, d’éditer depuis son logiciel de gestion de stock une étiquette avec codes-barres. Ce code-barres est positionné sur le dispositif à tracer, c’est lui qui va permettre de tracer le matériel médical lors de son utilisation. Cette étiquette et ce code-barres sont spécifiques au centre, charge au centre de retrouver la correspondance entre l’article et son code-barres maison.
Lorsqu’un retrait de lot est demandé suite à un problème identifié sur un dispositif médical, les centres doivent donc rechercher dans leurs traçabilités papier ou retrouver le transcodage effectué en cas de réétiquetage pour identifier les patients qui ont reçu le DM incriminé. Ce système est chronophage, peu performant et déconnecté de l’ère numérique dans laquelle nous vivons. Néanmoins, il est important de noter que ce travail a été effectué par les PUI depuis des années et chacune d’elle a su s’organiser pour être alignée à cette législation. Savoir reconnaître cela est important.

Le règlement (UE) 2017/745 :
En Avril 2017, le règlement (UE) 2017/745 du parlement européen relatif aux dispositifs médicaux introduit la notion de système d’identification unique des dispositifs (les codes IUD ou UDI) qui permet l’identification claire et formelle d’un dispositif médical et qui facilite leur traçabilité. C’est ce code qui va permettre une simplification de la mise en place du décret n° 2006-1497 du 29 novembre 2006.
Cette nouvelle législation s’inscrit dans une démarche mondiale de mise en place d’un code d’identification unique pour chaque dispositif médical. Ainsi les Etats-Unis fondent la Global Unique Device Identification Database (GUDID) et devance de quelques années l’Europe. Actuellement, aux États-Unis l’identification (UDI) est une exigence réglementaire obligatoire mise en place par la FDA (Food and Drug Administration). Le Japon s’inscrit aussi dans cette démarche.
Les établissements de santé français doivent désormais enregistrer et conserver les codes IUD des dispositifs afin d’assurer une sécurité efficace d’utilisation des Dispositifs Médicaux (DM), des Dispositifs Médicaux de Diagnostic In Vitro (DMDIV) et de leurs accessoires. Nous vous proposons de découvrir dans le prochain chapitre les différentes étapes de la mise en place de l’IUD en Europe.
Mise en place de l’IUD en Europe : quelles sont les grandes dates ?
Le règlement Européen (UE) 2017/745 relatif aux dispositifs médicaux est entré en vigueur en mai 2017. Sa date d’application était initialement établie au 26 mai 2020.
Dans le contexte de la crise sanitaire COVID-19, la date d’application a été reportée d’un an, soit au 26 mai 2021 suite au règlement modificatif (UE) 2020/561 du 23 avril 2020. En mars 2023 et devant un risque majeur de pénuries, cette date vient de nouveau d'être reportée de mai 2024 à fin 2027 ou fin 2028 en fonction de la classe du dispositif médical.
Quels sont les objectifs de l’identification unique des DM ?
L’objectif principal est bien évidemment d’améliorer la sécurisation de la prise en charge des patients et de concourir à une meilleure matériovigilance.
On peut raisonnablement élargir ce périmètre et lister les objectifs suivants :
- améliorer l’identification et la traçabilité des dispositifs
- renforcer la matériovigilance et améliorer l’effectivité des activités de sécurité après la commercialisation des dispositifs grâce à des mesures correctives de sécurité ciblées et à un meilleur contrôle par les autorités compétentes
- contribuer à réduire le nombre d’erreurs médicales
- améliorer le processus d’achat
- mieux gérer l’élimination de certains déchets
- améliorer la gestion des stocks par les établissements de santé et les autres opérateurs économiques.
L’objectif de ce code doit être rapproché de l’utilisation des codes UCD et CIP que nous connaissons bien pour la gestion des médicaments.
Après ces éléments de positionnement général, nous vous proposons de plonger dans la structure même du code IUD.
Que comporte l’identification unique des DM ?
L’identifiant unique des dispositifs (IUD ou UDI, Unique Device Identification) est un code numérique ou alphanumérique unique lié à un dispositif médical qui permet l'identification claire et formelle de dispositifs donnés sur le marché, à la fois individuellement et dans leur conditionnement, et qui facilite leur traçabilité.
L’IUD est un code-barres, un code QR ou tout autre code lisible par machine, il devra être compatible avec d’autres systèmes d’authentification déjà utilisés dans les établissements de santé.
L’IUD est constitué des éléments suivants :
- un identifiant «dispositif» (IUD-ID) : code unique propre à un fabricant et à un modèle de dispositif qui donne accès aux informations de conditionnement, unité de base , code entreprise, code produit. Ce code est unique pour chaque niveau de conditionnement du dispositif.
- un identifiant «production» (IUD-IP) : code unique qui identifie l'unité de production d'un dispositif comme le numéro de série, le numéro de lot, l'identifiant de logiciel, la date de fabrication et d'expiration
L’IUD viendra compléter, et non remplacer, les exigences existantes en matière d’étiquetage des dispositifs médicaux.
Quels sont les entités autorisées à produire un code IUD ?
Contrairement à ce que l’on peut penser en première approche, l’IUD n’est pas un code supplémentaire et n’a pas une structure unique.
Plusieurs organismes, spécialisés dans la production de codes-barres, sont autorisés par l’EMEA à utiliser leurs codes-barres comme codes IUD. Les opérateurs autorisés sont les suivants :
- GS1 (Global Standards 1)
- HIBCC (Health Industry Business Communications Council)
- IFA (Informationsstelle für Arzneispezialitäten)
- ICCBBA (International Council for Commonality in Blood Banking Automation)
Ainsi un code IUD aura une structure totalement différente qu’il s’agisse d’un code GS1, HIBCC, IFA ou ICCBBA.
Un industriel qui doit apposer un code IUD sur ses dispositifs médicaux aura donc le choix entre 4 opérateurs. L’industriel fera notamment son choix en fonction du marché qu’il veut atteindre ou du coût de chaque opérateur.
Quelles sont les structures des codes-barres IUD ?
Pour bien comprendre la philosophie générale du code IUD-ID, nous vous proposons une petite immersion dans la compréhension de la structuration de chacun des 4 codes IUD autorisés.
Un code-barres est analysable à l’aide de ses balises, le lecteur de code-barres va détecter les balises puis lire l’information contenue après cette balise. Chaque balise donne une information spécifique.
Concentrons-nous sur les 2 acteurs principaux dans le domaine des dispositifs médicaux : GS1 et HIBCC et analysons le contenu des balises.
Voici une liste non exhaustive et minimale pour comprendre comment cela fonctionne :
| Balise GS1 | Balise HIBCC | |
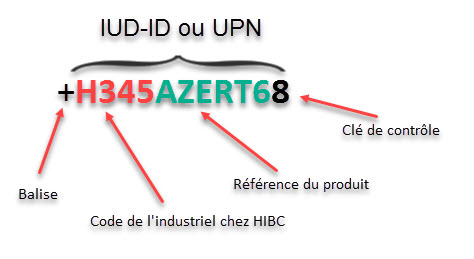
| Code IUD | (01) | + |
| Identification du numéro de lot | (10) | $$ |
| Identification de la date de péremption | (17) | $$ |
Le code IUD est donc visible dans la balise (01) pour GS1 et dans la balise + pour HIBCC.
Le code se nomme GTIN (anciennement EAN) pour GS1 et UPN pour HIBCC. Dans nos exemples, le code IUD sera donc soit un code GTIN ou un code UPN.
Chaque industriel souhaitant disposer d’un code IUD pour ses produits est adhérent à l’un des 4 opérateurs. Chaque opérateur attribue un code à ses sociétés adhérentes : ce code permet de reconnaitre l’industriel et est unique.
Pour chacun des acteurs, le process de génération d’un code IUD est toujours le même : il s’agit d’une concaténation du code unique, d’une société et d’un code unique pour un produit de cette société. Une clé de contrôle venant valider la chaine saisie.
Prenons l’exemple du produit imaginaire suivant :
- Nom du produit : Cupule bipolaire
- Société : HTS - Hanche Technologie Système
- Code HIBCC de cette société = H345
- Code GS1 de cette société = 4567896
- Référence du produit : AZERT6
Voici le code IUD pour HIBCC : H345AZERT68
Voici le code IUD pour GS1 : 456789678902

Le code-barres du dispositif médical ne s’arrête pas à l’IUD que ce soit un GTIN ou un UPN . Si on ajoute des balises supplémentaires, nous rajoutons des informations supplémentaires au code-barres.
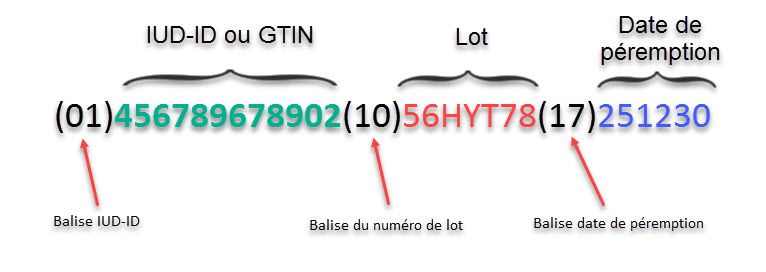
Ainsi il est judicieux dans notre cas - et pour un code GS1 - de rajouter les balises (10) et (17) pour obtenir l’information dont nous avons besoin pour tracer un dispositif médical.
Reprenons l’exemple du notre produit :
- Nom du produit : Cupule bipolaire
- Société : HTS - Hanche Technologie Système
- Code HIBCC de cette société = H345
- Code GS1 de cette société = 4567896
- Référence du produit : AZERT6
- Numéro de lot : 56HYT78
- Date de péremption : 30/12/2025
La suite de chiffres et de balises est ensuite transformée en « bâtons » et forme le code-barres. Il est à noter que ces « bâtons » ne sont en fait qu’une police de caractère particulière comme l’Arial ou le Calibri !

La même opération peut être effectuée en encapsulant l’IUD dans un Data Matrix :

Nous venons d’expliquer comme un code-barres est généré par l’industriel. Ce code-barres est apposé sur les boîtes de vos dispositifs médicaux. Vous achetez ou mettez en dépôt ce dispositif médical implantable. Que se passe-t-il en suite ? Comment retrouvez-vous l’information du code-barres et comment intégrez-vous celle-ci dans votre logiciel de gestion économique et financière ?
Comment tracer un dispositif médical à partir d’un code IUD ?
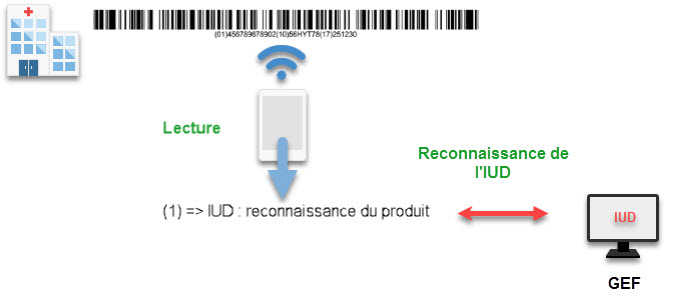
Lorsque vous lisez un code-barres avec votre lecteur, vous faites l’opération inverse de celle que nous venons de décrire : vous transformez les « bâtons » en un code contenant des balises identifiables.
Pour que le système fonctionne, vous devez disposer des codes IUD dans votre base de données, ainsi lorsque vous flashez un code-barres, votre éditeur de GEF récupère l’IUD-ID et retrouve l’identification de votre dispositif médical.
Le préalable est donc d’avoir un code IUD dans son logiciel hospitalier pour le dispositif que vous souhaitez tracer.

Pour injecter un code IUD dans les produits déjà présents dans votre GEF, vous devez réaliser une qualification de données qui consiste à reconnaitre chaque dispositif présent dans votre GEF et d’y associer un code IUD.
Une fois ce préalable réalisé, vous pouvez scanner le code-barres de votre dispositif. Le lecteur va lire le code-barres, c’est-à-dire reconnaître la police de caractère des « bâtons » et découper les balises.
La balise (1) qui est l’IUD permet de relier le dispositif à l’IUD que vous avez dans votre GEF, le premier élément reconnu est donc le code IUD pour identifier le dispositif médical de votre GEF.
Les autres balises – ici le n° de lot et la date de péremption – sont aussi reconnues puis envoyées vers votre logiciel de GEF. Les informations de lot et de date de péremption sont donc insérées dans votre GEF lors d’une réception de dispositif médical ou de traçabilité patient par exemple.
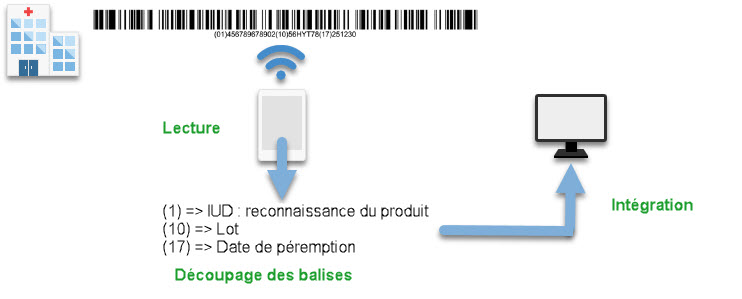
Si nous reprenons le schéma général, voici le résultat des différentes actions que nous venons de décrire.

Nous espérons que cet article vous aura été utile et qu’il vous aura apporté un éclairage constructif pour votre pratique professionnel.
Comment Exhausmed peut vous aider à la mise en place du IUD dans votre établissement de santé ?
Exhausmed met à votre disposition les codes IUD depuis la base de données dm.exhausmed.com, afin de garantir une traçabilité optimisée de vos dispositifs médicaux et une accessibilité maximale à toutes les données technico-réglementaires des DM.
Pour bénéficier de cette intégration, nous proposons plusieurs solutions :
- Qualification de vos dispositifs médicaux présents dans votre GEF. Cette action vous permet d’intégrer les codes IUD dans votre base de données
- Intégration de nos API (Application Programming Interface) dans votre GEF.
De nombreux éditeurs intègrent nos API (PHARMA, SOFTWAY, EVOLUCARE, CEGID, …) et vous permettent de bénéficier de la totalité de notre base de données directement depuis votre logiciel de gestion de stock, votre dossier patient informatisé ou votre logiciel d’aide à la prescription. Les API vous permettent aussi d’intégrer les codes IUD, dans votre logiciel hospitalier, en récupérant automatiquement les données Exhausmed. - Enfin vous pouvez visualiser et télécharger les données depuis notre solution en ligne dm.exhausmed.com
Comment vous pouvez nous contacter ?
- Par mail à info@exhausmed.com
- Par téléphone au 01 80 91 99 08
- Sur notre page contact : https://exhausmed.com/contact/
- Sur LinkedIn : https://www.linkedin.com/company/exhausmed/
- Par courrier :
EXHAUSMED
62 bis avenue Joffre,
94100 Saint-Maur des Fossés
https://exhausmed.com/contact/
